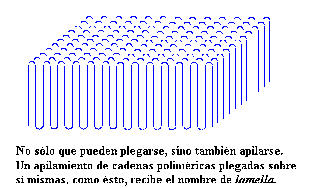
Y posiblemente de un futuro no muy lejano, pues cada día que pasa se reduce más el intervalo de tiempo entre un nuevo descubrimiento y la implementación de sus aplicaciones prácticas.
El grafeno es un buen ejemplo de esta aseveración. Aunque la Unión Internacional de Cristalografía (IUPAC) lo bautizó formalmente en 1994, no fue hasta 2004 que se logró separar por primera vez una capa individual de grafeno del grafito volumétrico. Ocurrió casi simultáneamente en la Universidad de Manchester (Inglaterra), y en el Instituto de Tecnología Microelectrónica de Chernogolovka (Rusia).
¿Qué es el grafeno?
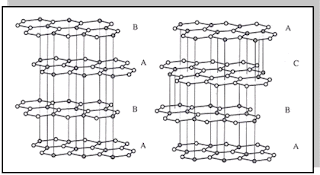
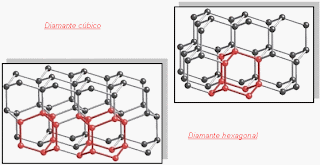
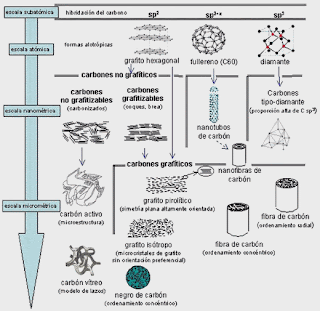
Los átomos de carbono forman dos tipos de sólidos estables con propiedades físicas muy diferentes; el diamante y el grafito. La diferencia es causada por la forma en que los átomos se ordenan a nivel microscópico. En el diamante -uno de los materiales más duros que existen- los átomos de carbono forman una malla tridimensional, entrelazada y compacta. En el grafito, mucho más blando, los átomos se ordenan en estructuras hexagonales similares a las de un panal de abejas. Esas celdas están fuertemente enlazadas por los costados, formando capas bidimensionales (ver figura). Sin embargo, los enlaces entre capas adyacentes son muy débiles, de manera que cada capa se desliza fácilmente respecto a las demás. De ahí proviene la ‘blandura’ del grafito, que deja fácilmente una huella en el papel y nos permite escribir con él. Es tan blando que se usa incluso como lubricante sólido.
Cada una de esas capas de carbono, esté o no integrada al grafito, es una capa de grafeno.
El descubrimiento de 2004 consistió en lograr obtener el grafeno separado de la estructura del grafito. Se obtuvo así un nuevo material, constituido por una sola capa bidimensional de carbono, con propiedades físicas muy diferentes a las del grafito volumétrico. El espesor de una capa de grafeno es tal que un solo gramo bastaría para cubrir totalmente un campo de fútbol.
El hallazgo del grafeno fue, sin lugar a dudas, algo sorprendente. Hasta ese momento, tanto la teoría como el experimento indicaban que no era posible la existencia de estructuras cristalinas bidimensionales desligadas del cristal volumétrico. Los cálculos indicaban que tal estructura sería inestable, y que tendría que colapsar para formar una estructura tridimensional normal.
A partir del descubrimiento comenzó una intensa investigación acerca de las propiedades del grafeno. Su alta transparencia óptica y gran conductividad eléctrica lo hacen un buen candidato para la confección de electrodos transparentes, aplicables a dispositivos tales como pantallas de cristal líquido, celdas fotoeléctricas orgánicas y diodos orgánicos emisores de luz. Su flexibilidad y alta resistencia mecánica también resultan ventajosas en comparación con las de otros materiales que se utilizan en la microelectrónica. Otra posible aplicación podría ser la confección de ultracondensadores, con una capacidad de almacenar carga eléctrica y energía mucho mayores que las de los existentes hasta el momento.
En diciembre de 2008 la IBM hizo público que habían logrado fabricar transistores de grafeno operando a frecuencias del orden de gigahertz. Anteriormente, en ese mismo año, se había reportado la construcción de un transistor ultrapequeño (1 átomo de espesor, 10 átomos de ancho).[1] Los transistores son la base de los circuitos integrados y de toda la electrónica moderna.
 .
. interaccionan débilmente entre si
El grafano
En enero de este año la revista Science reportó el descubrimiento del grafano, también en la Universidad de Manchester. El grafano posee una estructura monocapa similar a la del grafeno, con la diferencia de que los átomos de carbono, además de estar enlazados entre sí, lo están también a átomos de hidrógeno ubicados a ambos lados de la capa.[2] A diferencia del grafeno, el grafano no conduce la corriente eléctrica. Los enlaces con el hidrogeno ‘amarran’ los electrones responsables de la buena conductividad eléctrica del grafeno, convirtiéndolo en un aislante. No obstante, el grafano mantiene las buenas propiedades mecánicas de su antecesor: super resistencia mecánica, alta densidad y flexibilidad. Al calentar a una temperatura suficientemente alta el hidrogeno se elimina, y el grafano se convierte de nuevo en grafeno.
En principio, controlando la ubicación de los átomos de hidrogeno en la malla del grafeno sería posible construir materiales aislantes con regiones intermedias conductoras –principio de operación de infinidad de dispositivos microelectrónicos-. Pero quizás lo más importante sea que el descubrimiento del grafano abre las puertas a muchas otras modificaciones. Con el grafeno conductor en un extremo, y el aislante grafano en el otro, no es difícil vislumbrar una gran familia de nuevos materiales que aparecerán al sustituir el hidrógeno por átomos de otro tipo. Por ejemplo, en principio parece posible sustituir el hidrógeno, o parte de él, con flúor, cuyas posibilidades de enlace con el carbono son similares a las del hidrógeno. Así se obtendría un nuevo material con propiedades diferentes al grafeno y al grafano.
André Geim y Kostya Novoselov, quienes dirigen el grupo de investigaciones de la Universidad de Manchester, han expresado: “La industria moderna de semiconductores utiliza todos los elementos de la tabla periódica, aislantes, semiconductores y metales. Pero ¿que tal si un solo material pudiera ser modificado para cubrir el espectro completo necesario en todas las aplicaciones electrónicas?” Dada la gran cantidad de investigadores trabajando actualmente en este sentido, es muy posible que tales materiales aparezcan mucho antes de lo que se pudiera imaginar.

Grafano
Nombre: Edymar Gonzalez A
EES
http://www.fisica.uh.cu/bibvirtual/vida%20y%20tierra/grafeno/index.htm